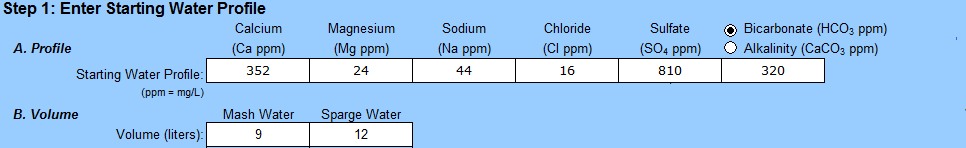
La gestione dell’acqua rappresenta per molti birrai casalinghi un tema ostico da gestire. Lo è stato (e per molti aspetti lo è ancora) anche per me, che per formazione ho sempre masticato poco la chimica. Fortunatamente, grazie al lavoro di alcuni smanettoni di buon cuore, sono disponibili in forma gratuita diversi fogli excel (qui, qui) in grado di fare tutti i calcoli al posto nostro.
Credo però sia molto importante comprendere alcuni concetti chiave che sono alla base di questi calcolatori, onde evitare di sparare sempre le solite minchiate in giro per i forum e i tanti gruppi attivi sul web. Fare bella figura, alla fine dei conti, fa sempre piacere a tutti. Ma, soprattutto, la conoscenza è utile anche per fare buona birra.
Oggi vorrei quindi riprendere l’ostico tema dell’alcalinità residua, cercando di affrontarlo tramite qualche esempio pratico, aiutandomi con il foglio excel “EZ Water Calculator” (download) che ha in chiaro tutte le formule ed è utilissimo per comprendere alcuni passaggi chiave. Cercherò di essere il meno prolisso possibile, promesso.
Definizione di alcalinità
Senza riscrivere il solito pippone, possiamo semplicemente dire che l’alcalinità determina la resistenza dell’acqua alla riduzione del pH quando si aggiunge acido in soluzione: maggiore l’alcalinità, maggiore la quantità di acido necessaria per abbassare il pH.
ll calcolo dell’alcalinità come valore numerico è complicato, ma possiamo semplificarlo. Nell’acqua, infatti, i composti che si oppongono alla discesa del pH possono essere solo di tre tipologie:
- carbonati (CO3)
- bicarbonati (HCO3)
- ioni idrossile (OH-)
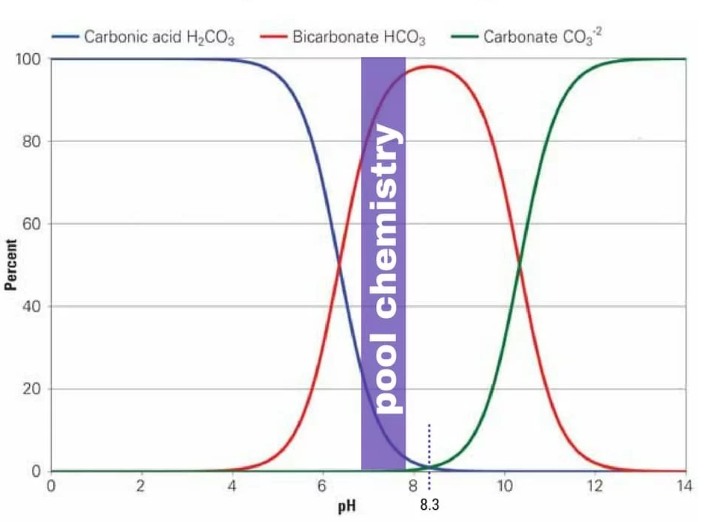
Fortunatamente, un simpatico grafico corre in nostro aiuto mostrandoci come, al pH dell’acqua potabile (in genere intorno a 8), la concentrazione di ioni idrossile è nulla (non è nel grafico ma lo potete leggere qui) e quella dei carbonati è di pochi punti percentuali rispetto a quella dei bicarbonati (il grafico evidenzia il range di pH utile per la gestione di una piscina, ma si vede bene che sotto pH 8 la percentuale di carbonati è zero).
Possiamo quindi affermare con gioia che, nel nostro caso, l’alcalinità dell’acqua coincide con la concentrazione di bicarbonati.
Questo grafico ci dice anche un’altra cosa molto importante: al contrario di quanto molti affermano, i bicarbonati non hanno influenza sul profilo organolettico della birra finita semplicemente perché non ce ne sono, di bicarbonati, nella birra finita. Se vi posizionate infatti su pH = 4.3 nel grafico sopra (il pH medio di una birra), notate come la loro percentuale è ininfluente (non necessariamente nulla) rispetto a quella dell’acido carbonico (e della CO2 disciolta). Ovviamente un effetto indiretto c’è, ma è sul pH di mash.
Che succede quando mischiamo i malti all’acqua?
Alcalinità residua
Quando i malti vengono mischiati all’acqua, calcio e magnesio interagiscono con i malti riducendo l’alcalinità della soluzione. Questo significa che, per capire a quale pH si assesterà la miscela, dobbiamo ricalcolare la nuova alcalinità della miscela.
Questo valore è chiamato Alcalinità Residua (RA, ovvero Residual Alkalinity) e sarà ovviamente minore rispetto a quello dell’alcalinità di partenza dell’acqua. La riduzione dell’alcalinità dipende dalla concentrazione di calcio e magnesio: maggiore la loro concentrazione, minore l’alcalinità residua.
Prima di rincoglionirci completamente e perdere il filo, passiamo all’esempio pratico.
Acqua di Burton
La mitica acqua di Burton viene spesso presa come riferimento quando si vuole produrre una IPA. Premesso che a mio parere questo approccio è da evitare assolutamente per via della folle concentrazione di solfati presente in quest’acqua, è interessante invece focalizzarsi su un altro aspetto.
Come è possibile produrre una birra chiara (o pseudo chiara, comunque non un stout) con tutti quei bicarbonati? Come facevano a Burton a far funzionare gli enzimi durante il mash con un’acqua del genere?
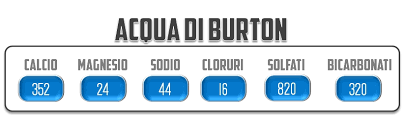
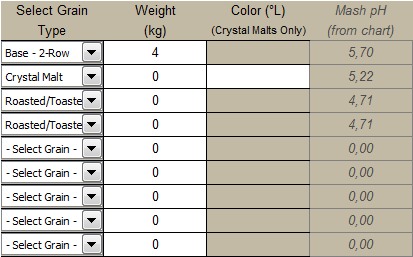
Mettiamo questi valori nel file di EZ Water Calculator, ipotizzando una produzione di 21 litri di birra senza contare per ora le perdite, che non ci interessano (i solfati sono leggermente sbagliati ma me ne sono accorto dopo e non mi andava di rifare tutti gli screenshot, perdonatemi):
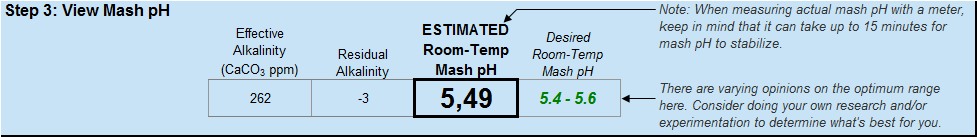
Se andiamo a smanettare con il programma, vediamo che l’alcalinità di quest’acqua vale 262, espressa come ppm di carbonato di calcio (ovvero ppm di CaCO3). Questo valore viene fuori semplicemente convertendo le ppm di bicarbonati (320) in ppm di CaC03. La costante di conversione è 0,82. 320 x 0,82 = 262.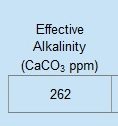 L’acqua di Burton ha quindi una alcalinità = 262 ppm di CaCO3, che è altissima. Questo significa che serve molto acido per far abbassare il pH di quest’acqua fino al valore di 4.3 (ovvero per eliminare tutti i bicarbonati, vedi grafico della piscina di cui sopra).
L’acqua di Burton ha quindi una alcalinità = 262 ppm di CaCO3, che è altissima. Questo significa che serve molto acido per far abbassare il pH di quest’acqua fino al valore di 4.3 (ovvero per eliminare tutti i bicarbonati, vedi grafico della piscina di cui sopra).
Per fortuna ci vengono in aiuto i malti.
Questi infatti, interagendo con calcio e magnesio, abbassano l’alcalinità dell’acqua. Quella che rimane è l’alcalinità residua. Di quanto viene ridotta l’alcalinità? La formula non è particolarmente complessa, c’è solo da stare attenti alle unità di misura. Proviamo a recuperarla dal file EZ Water Calculator:
Calcio e magnesio sono in mg/L (quindi in ppm, come nella tabella sopra), mentre l’alcalinità dell’acqua è in ppm di CaCO3, ma per fortuna abbiamo già fatto la conversione ottenendo un valore pari a 262. Mettiamo questi numeri nella formula:
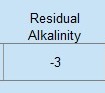
RA = 262 – [352/1,4 + 24/1,7 ] = -3
che torna con il numero che calcola EZ Water Calculator:
Ta-dah! Un numero negativo? Come è possibile?
 Ebbene sì, l’alcalinità residua dell’acqua di Burton è un numero negativo. Ma cosa diavolo significa? Vediamo.
Ebbene sì, l’alcalinità residua dell’acqua di Burton è un numero negativo. Ma cosa diavolo significa? Vediamo.
Il pH dei malti
Tutti i cereali hanno un proprio pH di riferimento. Questo viene misurato, convenzionalmente, simulando delle condizioni simili a quelle dell’ammostamento (in termini di rapporto tra Kg di malto e litri di acqua) utilizzando acqua distillata. Questo perché l’acqua distillata, essendo priva di minerali disciolti e avendo pH neutro, riesce a mettere in evidenza il potenziale acidificante del singolo cereale.
Più i malti sono tostati, maggiore è il loro potenziale acidificante (in realtà i malti crystal molto tostati hanno un potenziale acidificante maggiore di quello dei malti bruciati come il roasted, ma poco importa).
Attenzione: stiamo parlando del potenziale acidificante intrinseco dei malti, dovuto principalmente ai composti derivanti dalla tostatura (tra cui le melanoidine). Questo non ha nulla a che vedere con l’effetto di calcio e magnesio evidenziato sopra, dato che l’acqua distillata non contiene sali.
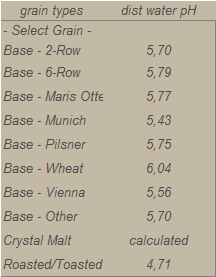
Sempre da EZ Water Calculator, è possibile scoprire quale sia questo pH in relazione alla tipologia di malto:
Vediamo che un malto base ha un potenziale acidificante sufficiente per portare il pH dell’acqua distillata (che è pari a 7 in origine) fino a 5,7. Un malto Vienna, maggiormente tostato, può farlo scendere fino a 5,56. Quando in ricetta impieghiamo un mix di diversi malti con diversi livelli di tostatura, il pH risultante di un mash in acqua distillata sarà un mix dell’effetto combinato dei diversi malti, pesato per le rispettive quantità.
Siamo arrivati al punto chiave: possiamo finalmente applicare coscientemente il parametro del l’alcalinità residua. Questa in pratica ci dice quanto il pH di mash si discosterà dalla situazione ideale in acqua distillata. In soldoni: se l’alcalinità residua è pari a zero, il mix di malti e acqua si comporterà esattamente come l’acqua distillata, offrendo resistenza nulla alla discesa del pH.
Se facciamo quindi un mash con 100% malto base in un’acqua che ha alcalinità residua pari a zero, il pH di mash sarà quello ideale. Ovvero, nel caso di malto base, si assesterà sul valore di 5,70.
Più l’alcalinità residua è maggiore di zero, più il pH di mash reale si discosterà (verso l’alto) dal valore ideale in acqua distillata. Più il valore dell’alcalinità residua è negativo, maggiore sarà invece lo scostamento verso il basso.
Facile, no?
Birra chiara e acqua di Burton
Proviamo allora a fare una ricetta di solo malto base con l’acqua di Burton. Ipotizziamo di voler produrre una birra da circa 1,050 di densità utilizzando 4 Kg di malto base.
Indovinate dove si assesterà il pH di mash? Vi ricordo che l’alcalinità residua che avevamo calcolato è poco minore di zero… oplà!
 Ph quasi ottimale anche senza l’utilizzo di acidi.
Ph quasi ottimale anche senza l’utilizzo di acidi.
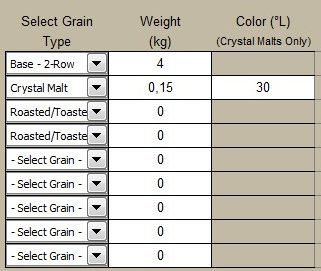
Proviamo ora ad aggiungere un filo di crystal da 30L (60 EBC), facciamo un 4% (le IPA di Burton erano piuttosto ambrate).
E di nuovo oplà: pH di mash perfetto.
Siamo arrivati al pH di mash ideale senza aggiungere nessun acido e solo con un filo di malto tostato. Eccoci, di fatto, vestire i panni dei birrai di Burton-On-Trent.
Visto? Nonostante la quantità spropositata di bicarbonati, con l’acqua di Burton si arriva facilmente in un range di pH decente anche utilizzando quasi solo malti chiari e senza aggiungere acidi.
Questo grazie all’effetto di calcio e magnesio che abbassano l’alcalinità dell’acqua generando una alcalinità residua pari a zero che non offre praticamente nessuna resistenza all’abbassamento del pH.
E ancora: abbiamo mai considerato il pH dell’acqua di partenza come valore di riferimento? No, non ci è servito assolutamente a nulla. Quindi smettiamola di dire in giro “la mia acqua ha pH pinco o pallo“, non ce ne frega una ceppa.
Tutto chiaro, no?
Perché ricreare l’acqua di Burton è da idioti
Be’, dovrebbe essere chiaro ormai. Mettersi ad aggiungere bicarbonato di sodio o carbonato di calcio (tra l’altro poco solubile in acqua potabile) per far salire i bicarbonati a 320 e aggiungere Gypsum per far salire il calcio a 352 per fare in modo che poi i due effetti si compensino abbassando l’alcalinità è un po’ come aggiungere sale alla pasta in bollitura per poi risciacquarla con acqua dopo la cottura.
Non ha alcun senso.
Senza parlare poi dei solfati che a quel livello sono molto pericolosi per il profilo organolettico.
Io vi ho avvertito.
Lezione in formato video
Per chi fosse interessato, è disponibile su YouTube una registrazione video in cui affronto nel dettaglio l’argomento trattato in questo post. Il video è la prima puntata di un progetto ideato da James Bonanni di Homebrewing Experience e Davide Cantoni di RovidBeer chiamato Homebrewing Experience Academy. L’idea è di chiamare homebrewer con esperienza a parlare di argomenti a rotazione. La lezione si svolge in diretta tramite la piattaforma Discord. Maggiori informazioni le trovate qui.


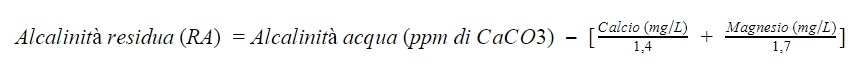




Ciao e complimenti come al solito per la chiarezza di esposizione. Non mi è chiaro un passaggio: scrivi “Calcio e magnesio sono in g/L (quindi in ppm, come nella tabella sopra)”… C’è forse un refuso nella formula?
ppm = mg/L e non g/L.
Vero, grazie! È un refuso. Dopo correggo
Articolo estremamente interessante!
Unico dettaglio che non mi è chiaro: i bicarbonati HCO3 a ph di circa 4 che diventano? Anche se rimangono in presenza elevata nell’acqua non danno alcuna caratteristica alla birra?
Come si vede dal grafico si convertono in CO2 disciolta e acido carbonico. “Se rimangono in presenza elevata” dove? Quando il pH arriva a 4 non ci sono bicarbonati, punto. I bicarbonati influiscono indirettamente sull’aspetto organolettico solo perché contribuiscono a determinare il valore di assestamento del pH nella fase di ammostamento. Da questo punto in poi è il pH a influire sul processo, non i bicarbonati (che una volta che il pH scende intorno a 5 sono ininfluenti.
Chiarissimo. Frank Top!
Complimenti Frank! Come sempre con la tua logica ed il tuo modo di spiegare / scrivere riesci a semplificare e a rendere chiari gli argomenti più ostici.
Ho letto da poco il libro sull’acqua di Palmer, e l’alcalinità è stata davvero tosta da capire (anche se sono chimico i miei ricordi scolastici si stanno perdendo nella memoria 🙂 )
Ancora complimenti!
Grazie!
Grande come sempre, ed è bello vedere che non sono l’unico a trovare poco intelligente diventare matti per replicare i profili delle acque delle città dove son nati gli stili. Tralasciando che il mondo della birra è in evoluzione continua e che siamo arrivati ad una qualità potenziale per la birra come mai nella storia birraria, ci si dimentica che anche in passato i birrai avevano modi per modificare l’acqua e li usavano, per non dire che non avevano scelto quell’acqua ma semplicemente tentato di adattarvisi con le risorse che avevano a disposizione all’epoca. Sláinte Frank!
Complimenti come al solito! John Palmer dovrebbe prendere lezioni da te su come si spiegano in maniera semplice e chiara concetti complicati. Ci sono stati momenti in cui avrei voluto bruciare il suo libro Water! Grazie
Ciao Frank, ma per quanto riguarda la sezione dell’acido l’acido lattico, quella quantità va aggiunta solo al mash? Per l’acqua di sparge come ti comporti?
L’acqua di sparge va portata al ph di mash (o anche un po’ meno), in genere 5.5 – 5.2, altrimenti quando la aggiungi fa rialzare il pH. Se arriva sopra al 6 rischi anche di estrarre troppi tannini dalle glumelle dei malti durante lo sparge.
Ho letto 4 libri in 4 mesi per capire perfettamente quello che hai spiegato te in un’ora molto più chiaramente..!
Bravo, tecnico e appassionato, continua così!
Grazie!
Con EZ Water Calculator, aggiustando il pH tramite acido lattivo mi viene una alcalinità negativa, e quella residua anche. Che vuol dire? Ho sbagliato qualcosa?
Dalla domanda mi pare che non hai letto il post qui sopra… 🙂
Ciao Frank. Io ho installato un depuratore a osmosi inversa dedicato con relativo contalitri, a cui ho tolto la cartuccia che aggiunge sali minerali (perché non si sa quanti e quali). Quindi parto da acqua demineralizzata, con profilo source tutto a zero. In queste condizioni non sono riuscito a trovare un profilo targett compatibile con quello richiesto ad esempio per una IPA che porti a zero l’alcalinità residua, che rimane sempre molto negativa. L’ultimo che sto calcolando porta ad un valore previsto di -33. Secondo te è un problema?
Dipende a che pH di mash ti porta quell’alcalinità residua, e questo dipende dal grist di malti. A ogni modo io uso acqua osmotizzata ma la miscelo con acqua di rete (crica 70% osmosi e 30% rete) passata solo attraverso il filtro a carboni attivi per rimuovere il cloro. In questo modo parto con profili in genere intorno alle 100 ppm di bicarbonati sprecando meno acqua dal processo di osmosi (e anche meno tempo per produrla). Aggiungendo poi Gyspum e Solfato di Calcio mi creo il profilo voluto, e comunque uso sempre un po’ di acido lattico in mash per bilanciare l’alcalinità residua che rimane un filo alta per molti grist ma assolutamente gestibile.
Ciao Frank! Potrebbe essere che i carbonati rimasti nel mosto dopo la bollitura fungano da tampone nella discesa di pH durante la prima fase di fermentazione? Esempio: prodotti diversi mosti 100% pils con acqua ad alcalinità prossima allo 0 (c.ca 10ppm), pH mash 5.4 (acidificando leggermente), pH boil 5.3, preinoculo 5.2…post fermentazione 4! Un po’ al limite, anche se in una chiara luppolata non guasta. In birre più scure e maltate il pH così basso cozza un pochino con gli aromi dei Malti più tostati nonostante il pH in produzione è perfettamente nei parametri ideali, avendo mantenuto le aggiunte di sali calibrate per ottenere un’alcalinità residua tale da non dover correggere pH con acidi. Grazie e complimenti
Mmh, non mi è chiarissima la domanda. Anzitutto, i bicarbonati che rimangono nel mosto a ph 5.1-5.2 (dopo la bollitura) sono trascurabili, quindi contano poco (come si vede dal grafico nel post). Durante la fermentazione poi ci sono tantissimi altri fattori che giocano sul pH, a partire dai vari acidi prodotti dal lievito. Ma non ho capito qual è il tuo problema. Un pH 4 a fine fermentazione è normale, non ci vedo grandi problemi. Non ho capito perchè un pH basso dovrebbe “cozzare” con gli aromi dei malti. C’è chi dice che un pH un po più alto nella birra finita renda più “aperta” la percezione dei malti (ma non in aroma), ma non so quanto questo influisca davvero e cmq non c’è granché che puoi fare visto che guida più che altro il leivito. Il pH finale può essere parzialmente influenzato dal pH post boil, ma il tuo è a 5.2 quindi mi sembra ok.
Grazie per la celere risposta! Ho provato il pH in birre acquistate in diversi birrifici e ho notato che si attesta sempre sul 4.3/4.4 mentre le mie non si smuovono dal 4/4.1 (birra finita carbonata a T°ambiente) e mi chiedevo dipendesse dall’acqua usata(RO) ma come mi hai confermato anche tu i carbonati non influiscono. Il dubbio mi è sorto avendo prodotto una altbier che risulta un po’ spigolosa (pH 4).. proverò a tenere più alto il pH preinoculo! Grazie mille ancora