La mia indole da ingegnere e l’abitudine a maneggiare numeri, ormai parte del mio lavoro da più di 15 anni, si sono sempre riflesse nel mio approccio alla produzione casalinga di birra. Cerco sempre di assegnare un numero, dove possibile, ai risultati delle mie azioni e delle mie scelte in ambito produttivo. Del resto lo faccio anche quando mi applico come giudice, descrivendo le birre che assaggio in modo qualitativo ma alla fine assegnando numero all’aspetto visivo, al gusto, all’olfatto. Numeri che esprimono una valutazione il più possibile oggettiva e che alla fine vanno a comporre una classifica.
Il fatto che l’ossigeno sia diventato così importante nelle mie dinamiche produttive – sia la sua ricerca, prima dell’inoculo del lievito, sia la sua eliminazione, nelle fasi successive – e l’ingombrante inconveniente di non poterlo tuttavia misurare, mi ha sempre creato un certo fastidio interiore. Se quello disciolto post fermentazione rimane, ahimè, non misurabile in ambito casalingo, su quello pre-inoculo qualcosa si può fare. E l’ho fatto. Con un salto in un mondo che conosco poco – quello dei misuratori di ossigeno, altrimenti detti ossimetri o DO-meters in inglese – ho tentato di assegnare un numero alle mie azioni. L’ambito è difficile, lo strumento costoso, ma qualche informazione a mio parere interessante sono riuscito a tirarla fuori con questo primo esperimento.
Come funziona un misuratore di ossigeno disciolto
Come anticipato nel cappello introduttivo, nell’ambito del processo produttivo esiste uno spartiacque tra due tipologie di ossigeno disciolto: quello nel mosto, i cui target sono nell’ordine delle ppm (parti per milione, ovvero mg/L), e quello nella birra, dove i target si attestano su concentrazioni 1000 volte più piccole, intorno alle decine di ppb (parti per miliardo, µg/L). Spesso un solo strumento non riesce a gestire entrambe le sensibilità, e quelli con sensibilità per le ppb costano ovviamente molto di più. Ma il problema non è solo questo.
Per valutare l’ossigeno che si trasferisce in bottiglia (o in lattina) e che nel tempo determinerà la shelf life della birra (ovvero il periodo temporale in cui manterrà intatte le caratteristiche organolettiche) non è sufficiente misurare l’ossigeno disciolto nella birra, ma è necessario misurare anche quello che rimane nello spazio vuoto di testa. La somma dei due valori si chiama TPO (Total Packaged Oxygen) e si misura con macchinari costosi e complessi che perforano la bottiglia (o la lattina), misurano l’ossigeno disciolto nella birra – dopo che questa è stata agitata per 3-5 minuti per raggiungere l’equilibrio con lo spazio di testa – e in base a ragionamenti volumetrici e alle equazioni di equilibrio dei gas calcolano il TPO. Questo approccio alla misura è infattibile in casa, quindi tocca metterci una pietra sopra. A meno che non si disponga di un birrificio o di un laboratorio dotato di questi macchinari vicino casa – perché la misura va fatta appena tappata la bottiglia – ma questo è un altro scenario. Non il mio, attualmente (non metto limiti al futuro).
Nella foto qui sotto un macchinario della Hach per misurare il TPO, utilizzato dal birrificio americano Columbus Brewing Company. Non proprio uno strumento di misura trasferibile agli ambiti di produzione casalinga.

L’ossigeno disciolto nel mosto al momento dell’inoculo del lievito è invece misurabile con strumenti più alla portata dell’homebrewer. Siamo nel range delle parti per milione (ppm), la misura si può fare anche in una tazzina di mosto a contatto con l’aria se si agisce abbastanza velocemente. Come è intuibile, essendo l’aria permeata da ossigeno al 21%, lasciando il mosto a contatto con l’aria vi è una costante solubilizzazione di ossigeno nel mosto fino al valore di saturazione. Tuttavia, se non si agita troppo il campione, la solubilizzazione è lenta. Non dovendo misurare concentrazioni bassissime (come nel caso delle ppb in bottiglia), la misura viene falsata molto poco dall’assorbimento dell’ossigeno dall’aria.
Gli strumenti di misura sono portatili e costano meno del catafalco nella foto sopra. Certo, per avere misure stabili e accurate servirebbero strumenti di misura più costosi (sebbene sempre portatili), ma come nella misura del pH ci si può accontentare di apparecchi economici e non precisissimi. Ovviamente economici dato l’ambito, non economici di per se’.
Per avvicinarmi a questo mondo mi sono quindi rivolto al mio produttore di fiducia, da cui da anni acquisto il misuratore di pH che mi dà sempre grandi soddisfazioni. Purtroppo i rivenditori italiani non vendono questo prodotto della Milwaukee, per cui ho dovuto fare un acquisto diretto dal loro sito. Fortunatamente spediscono in Europa dall’Ungheria, con spesa di spedizione gratuita per acquisti superiori ai 50€. Spedizione velocissima con corriere espresso: due giorni dopo l’ordine avevo lo strumento in casa.
Vi chiederete: ma vale la pena spendere oltre 200€ per misurare l’ossigeno disciolto nel mosto prima dell’inoculo del lievito? La risposta sincera è – ovviamente – no, non serve. Ma siccome ho un blog su cui scrivere articoli, siccome sono curioso di natura, siccome sono ingegnere, e soprattutto siccome spendo un sacco di soldi per l’homebrewing in ogni caso, mi sono detto: perché no? Proviamo. Ed eccomi qua.
Come calibrarlo (e come l’ho calibrato io)
Purtroppo il misuratore di ossigeno non è affatto semplice da utilizzare. Basta poco per sballare completamente la misura, anche se il range che stiamo misurando è in ppm (che comunque, intendiamoci, sono pur sempre valori molto piccoli). Il primo vero ostacolo è la taratura dello strumento.
A differenza del phmetro, che si può tarare semplicemente con due soluzioni di riferimento acquistabili a parte che durano un bel po’ di tempo, l’ossimetro presenta una calibrazione più complicata. Quelli più buoni, e questo non è male, si tarano su due punti di riferimento: acqua a zero ossigeno disciolto e aria umida. Detto così sembra facile, ma non lo è.
Disporre di aria a zero ossigeno disciolto non è semplice. La Milwaukee ovviamente vende una soluzione di questo tipo, ma sul sito non viene nemmeno indicato il prezzo e soprattutto non è riutilizzabile. Visto che la taratura va fatta almeno ogni volta che si cambia la membrana (il misuratore viene fornito con 5 membrane, quindi immagino si cambi abbastanza spesso) ho pensato che potevo prepararmi in qualche modo da solo questa soluzione. Leggendo diverse fonti, come questo articolo di Brew Your Own o quello nell’immagine sotto, ho capito che per preparare una soluzione a zero ossigeno sostanzialmente si mescolano acqua distillata e un agente antiossidante. Nell’articolo sotto parlano di solfito di sodio (acquistabile anche su Amazon), mentre nell’articolo di BYO usano il tanto vituperato metabisolfito di potassio (che non è tanto efficace come sanitizzante in ambito birrario, ma è un ottimo antifermentativo e antiossidante). Visto che avrei dovuto fare a breve un acquisto per le materie prime, ho optato per il metabisolfito di potassio. Secondo l’articolo di BYO, un grammo di metabisolfito sciolto in un litro di acqua distillata produce una soluzione a zero ossigeno ottima per tarare lo strumento. Nell’articolo dell’immagine, dove viene consigliata la soluzione con solfito di sodio, non vengono invece indicate le dosi.
Bene, la mia soluzione non ha funzionato. Ho provato a fare diverse soluzioni con diversi dosaggi (tanto non dovevo bere la soluzione, quindi anche un dosaggio eccessivo non creava pericoli) ma niente: la misura era sempre molto al disopra delle 0 ppm. Ora, anche se il misuratore era da tarare, il fatto che desse misure di 7-8 ppm (praticamente la concentrazione di ossigeno standard nell’acqua) mi ha insospettito.
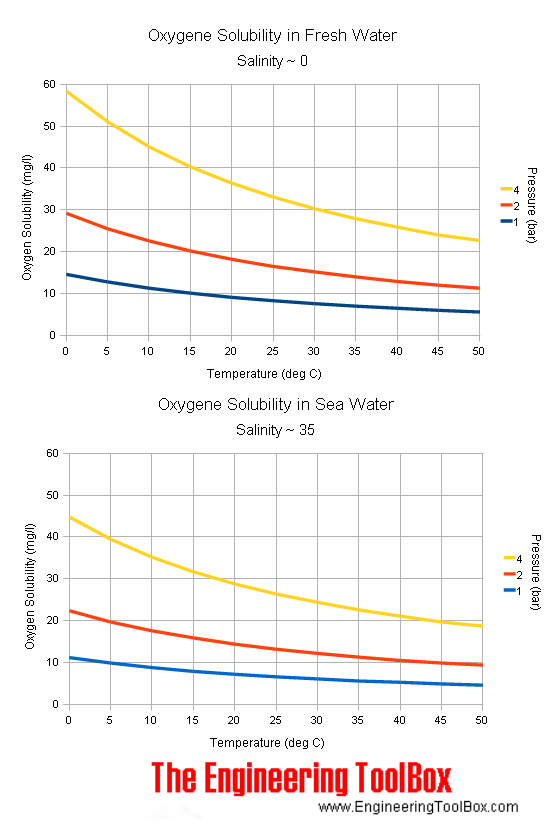
Ma la conferma che qualcosa non stesse andando per il verso giusto l’ho avuta alla taratura sul secondo punto, quello in aria umida. Per la calibrazione in aria umida, da quello che ho capito dall’articolo di BYO citato sopra e anche dalle istruzioni del misuratore di ossigeno, si posiziona la sonda in aria ma immediatamente sopra a un contenitore pieno di acqua, in modo da ottenere una saturazione dell’aria con l’umidità. A questo punto si ruota la seconda piccola vite del misuratore di ossigeno, fino a quando non compare il valore 100% sul display. Cosa significa questo 100%? Stando sempre a quello che ho capito, l’aria a temperatura ambiente dovrebbe essere circa al 21% in concentrazione di ossigeno che il misuratore dovrebbe leggere come circa 8,26 ppm alla saturazione al 100% (vedi immagine sotto, presa da questo calcolatore online). Di fatto, la sonda lasciata libera nell’aria dovrebbe misurare “intorno” alle 8,26 ppm a zero elevazione e temperatura di 25°C. Se io taravo la misura a zero ppm con la mia soluzione di metabisolfito girando l’altra piccola vite, la sonda lasciata in aria leggeva valori troppo bassi e in aria umida non riuscivo ad arrivare al valore 100% girando l’altra vite. Tutti questi indizi mi hanno portato a pensare che la soluzione metabisolfito e acqua non fosse effettivamente a zero ossigeno disciolto.

Cosa fare, quindi? A questo punto mi sono arrangiato e sono andato di fantasia, operando la taratura a zero ppm con acqua distillata lasciata bollire per una ventina di minuti. Questa operazione non produce una soluzione a zero ossigeno (il tempo di bollitura è troppo poco), ma probabilmente ci si avvicina. Altro problema è che raffreddando la soluzione entra inevitabilmente ossigeno, anche se immagino non molto se si chiude il contenitore con una pellicola.
Questa seconda procedura mi ha portato a una taratura apparentemente accettabile. Come controprova ho messo un po’ di acqua distillata in un contenitore, l’ho agitata un po’ e l’ho lasciata diverse ore a contatto con l’aria con il contenitore aperto e una ampia superficie di scambio. Questo avrebbe dovuto portare la concentrazione di ossigeno nell’acqua al punto di saturazione a temperatura ambiente (circa 25°C), che è intorno alle 8 ppm (vedi immagine sotto presa da questo articolo). La lettura che ho fatto successivamente con il misuratore di ossigeno tarato mi ha dato un valore molto vicino.
Insomma: alla fine in qualche modo sono riuscito a ottenere una taratura decente, ma certo la procedura non è semplice e nemmeno molto rigorosa. Non sono convinto di averlo tarato bene al 100% (come si evincerà nel seguito). Credo tuttavia di averne ricavato delle prime misure accettabili.
Come ossigeno il mosto
Nella mia vita da homebrewer sono passato attraverso diverse pratiche di ossigenazione: dal semplice trasferimento “violento” del mosto da un fermentatore all’altro, alla pompetta per acquari con pietra porosa, al trapano con paletta, alla bombola di ossigeno puro. Tuttavia, fino ad oggi, i riscontri sull’ossigeno disciolto sono stati meramente qualitativi. Non potendo misurare l’effettiva concentrazione di ossigeno nel mosto, mi limitavo a osservare la fermentazione. Se andava bene, e questo “bene” è molto soggettivo, l’ossigenazione era sufficiente. Ma, ovviamente, i fattori che possono alterare le dinamiche di una fermentazione sono talmente tanti (tasso di inoculo, efficacia dello starter, temperature, nutrienti, effettiva composizione degli zuccheri nel mosto) che attribuire una buona fermentazione alla sola ossigenazione rappresenta un significativo slancio di ottimismo.
Inoltre, a un certo punto ho imparato che con i lieviti secchi non serve nemmeno ossigenare, per cui sono tornato all’ossigenazione del mosto con paletta e avvitatore, per un minuto. Il passaggio ai keg mi ha aiutato perché, essendo alti e stretti, non lasciano schizzare mosto da tutte le parti. Ho comunque continuato a ossigenare anche quando uso lieviti secchi perché, sebbene non è necessario, male non fa e mi costa poca fatica.
In questa nuova stagione ho deciso di concentrarmi maggiormente sulle produzioni ad alta OG (densità iniziale). Come si sa, necessitano di una ossigenazione più intensa anche per il fatto che l’alta concentrazione di zuccheri limita molto la solubilità dell’ossigeno nel mosto. Ho deciso allora di riprendere in il progettino “ossigenazione con bombola di ossigeno per saldatura”, di cui avevo già ampiamente discusso qui. Avendo ormai un po’ di esperienza con le bombole e i relativi connettori grazie all’utilizzo di CO2, è venuto fuori un sistemino più comodo del precedente.
Bombola e riduttore li ho acquistati da Leroy Merlin, il flussometro da Amazon, i vari tubicini anche su Amazon (ma non ricordo dove) oppure, nel caso del tubo in silicone più grande, sui siti di prodotti hb (così come i connettori sulla destra). L’accrocchio sulla destra non è essenziale, ma in questo modo si evita che eventuali oli contenuti nelle giunture di bombola e riduttore (che non sono foodgrade) finiscano nella birra. Sul fondo della bottiglia c’è semplice acqua di bottiglia. L’ossigeno entra nell’acqua, si libera di eventuali residui solidi, passa nello spazio vuoto all’interno della bottiglia, esce dal tubo e arriva nella birra.

Misure sul campo
Per questo primo esperimento (ne seguiranno altri a breve) ho utilizzato il mosto di una imperial stout, bollito per due ore, arrivato alla densità di 1.099.
 Secondo la Wyeast (ma anche secondo diverse altre fonti), il target ideale di ossigeno disciolto per garantire una fermentazione ottimale (chiaramente quando si utilizzano lieviti liquidi) è di circa 10 ppm. Difficile arrivare a questo valore con semplice mescolamento o agitazione. Sempre secondo la Wyeast, anche con 5 minuti di pompa da acquario non si riesce ad arrivare oltre le 8 ppm, quando va bene.
Secondo la Wyeast (ma anche secondo diverse altre fonti), il target ideale di ossigeno disciolto per garantire una fermentazione ottimale (chiaramente quando si utilizzano lieviti liquidi) è di circa 10 ppm. Difficile arrivare a questo valore con semplice mescolamento o agitazione. Sempre secondo la Wyeast, anche con 5 minuti di pompa da acquario non si riesce ad arrivare oltre le 8 ppm, quando va bene.
Vediamo ora le mie misure.

La prima è stata fatta nell’acqua di rete passata per l’impianto di osmosi. Ho misurato 8.1 mg/L ovvero 8.1 ppm di ossigeno disciolto, che tornerebbe con il valore standard contenuto nell’acqua in condizioni di equilibrio con l’aria. La misura successiva l’ho fatta sul mosto appena raffreddato, dopo due ore di bollitura. In questo caso avrebbe dovuto essere attorno allo zero, mentre è risultata negativa. Nella foto è a -0.1 ppm, ma poi è scesa ancora un po’ fino -0.4. Anche questo valore, bene o male, mi torna: due ore di bollitura dovrebbero davvero togliere tutto l’ossigeno (a meno di quel poco che si solubilizza dall’aria durante il raffreddamento). Siccome avevo tarato con acqua bollita solo 20 minuti, è ragionevole che la taratura fosse un po’ sballata.
Andiamo ora alle misure dopo l’aerazione. La prima, che misura 5.6 ppm, è stata fatta dopo 1 minuto di agitazione con trapano e paletta. Probabilmente è leggermente imprecisa per via della taratura a zero non perfetta, ma torna abbastanza con i valori di ossigeno che ci si aspetta di solubilizzare con paletta in un mosto così denso (ovvero meno di 8 ppm). L’ultima misura, pari a 10.2 ppm, è stata invece fatta dopo un minuto di bombola di ossigeno collegata alla pietra porosa (dopo l’aerazione con paletta). Mi sarei aspettato un valore un po’ più alto, anche considerando che nel mosto c’erano già 5.6 ppm di ossigeno, ma a ogni modo il valore è raddoppiato, segno che la bombola il suo effetto ce l’ha.
Conclusioni
Devo ammettere che tutte queste tarature e misure sono un gran sbattimento di maroni, ma per onore della scienza si fa questo e altro! Considerando poi che ho usato lievito secco per fermentare questa stout, l’ossigenazione forse non era nemmeno così necessaria. Anche se con questa densità sicuramente aiuta.
Detto ciò, è stato senza dubbio un esperimento molto interessante. Devo lavorare un po’ sulla soluzione di taratura a zero ppm, ma per il resto più o meno i valori mi tornano. Non ho tenuto in conto la salinità della soluzione, che andrebbe considerata per aggiustare le misure dell’ossimetro. Sebbene nel manuale del densimetro ci sia una tabella da usare per convertire le misure in base alla concentrazione di cloruri della soluzione, la questione non mi è completamente chiara. Soprattutto, mi chiedo: come fanno i vari birrifici a conoscere esattamente la salinità di ogni mosto che producono quando misurano le ppm di ossigeno disciolto? Secondo me, ma questa è una mia idea, le misure fatte nel mosto con questa strumentazione (e i relativi valori di riferimento, tipo le 10 ppm della Wyeast) non vengono compensate con la salinità. Ma questa è una mia idea.
Dato che è tutto piuttosto complicato, e non è detto che io abbia afferrato correttamente i vari principi fisico-chimici (anzi, probabilmente no), se qualcuno ha suggerimenti/osservazioni sono assolutamente benvenuti tra i commenti del post.






Ciao Frank, premetto che non ne capisco di tarature di ossimetri…. Però leggendo il tuo articolo mi sono venute in mente due cose che vorrei suggerirti:
1) ho letto che un grammo di metabisolfito contiene 550 mg di anidride solforosa quindi, sciogliendolo in 1 litro di acqua, immagino che queste 550 pom dovrebbero spiazzare le ppm di aria disciolta, che facendo le proporzioni con gli 8,26 pom di O2, mi dovrebbero dare circa 39 pom di aria disciolta nel litro di acqua. Per facilitare la formazione di anidride solforosa e lo “strippaggio” dell’aria, forse dovresti agitare il litro di soluzione in un barattolo e poi aprire il tappo.
2) 100% immagino sia la percentuale di umidità. Inoltre lo strumento ho capito che funziona se il capillare è umido/bagnato. Quindi, probabilmente, dovresti metterlo sopra i vapori di acqua distillata che bolle, in modo che l’aria che lambisce la testina del misuratore, sicuramente sarà satura al 100% di umidità.
Non so se magari ho detto baggianate, ma nel nome della scienza potresti provare a fare queste altre sue prove 😂😂
Ciao Emanuele, grazie per il feedback! La soluzione l’ho agitata più volte in una bottiglia chiusa, ma niente. Non conosco la reazione di dettaglio che forma i solfiti partendo dall’ossigeno, quindi non saprei. A ogni modo ho provato diverse concentrazioni (anche molto più alte) ma niente. Riproverò, probabilmente con solfito di sodio. Sul secondo punto, la soluzione si tara poggiando su aria umida, come spiegato anche in diversi video di taratura che si trovano su youtube, come questo della Hanna: https://www.youtube.com/watch?v=fim0mVx62vs. Se mettessi la sonda sopra all’acqua bollente, probabilmente si rovinerebbe. Una cosa che posso provare è eseguire le misure con l’agitatore magnetico, come nel video.
Ciao Frank,
Noi in laboratorio per fare lo zero della nostra sonda pO2 utilizziamo una soluzione SATURA di solfito di sodio. Ciò significa che dovresti solubilizzare il suddetto sale in acqua fino a che non vedi un bel corpo di fondo. La sonda poi la lasciamo immersa per almeno 15-20 minuti.
L’alternativa (più veloce ed efficace) é quella di far flussare azoto puro in una piccola camera di calibrazione (come ad esempio potrebbe essere “l’accrocchio di destra” descritto nella foto dove c’é la bombola di anidride carbonica) in cui viene creato un ambiente completamente anossico. In questo caso immagino che potresti utilizzare la stessa bombola di anidride carbonica anzichè l’azoto. Qualsiasi gas va bene, basta che non contenga ossigeno. Spero di esserti stato utile e complimenti per l’articolo!
Grazie mille per i consigli! Avevo appunto già acquistato solfito di sodio, devo solo trovare tempo e pazienza per ritarare e riprovare il tutto. 🙂